Biopsia líquida: Una realidad en el cáncer de mama
La detección y análisis del ADN circulante tumoral mediante muestras de sangre periférica sin la necesidad de una biopsia tisular es una herramienta prometedora en el campo de la Oncología Médica que se está implementando en la monitorización y tratamiento individualizado del cáncer de mama.

Doctor José Ángel García Sáenz, Oncólogo Médico y Especialista en Cáncer de Mama.
El cáncer de mama es un problema de Salud Pública de primera magnitud porque afecta a millones de mujeres en todo el mundo y, lamentablemente, se ha consolidado como una de las principales causas de muerte por cáncer en la población femenina.
Según las cifras del cáncer en España , un informe anual editado por la Sociedad Española de Oncología Médica (SEOM) en colaboración con la Red Española de Registros de Cáncer (REDECAN), el cáncer de mama será el cáncer con mayor incidencia en las mujeres de nuestro país durante 2023 con una estimación de 35.001 nuevos casos.
, un informe anual editado por la Sociedad Española de Oncología Médica (SEOM) en colaboración con la Red Española de Registros de Cáncer (REDECAN), el cáncer de mama será el cáncer con mayor incidencia en las mujeres de nuestro país durante 2023 con una estimación de 35.001 nuevos casos.
El estudio de la biopsia de tejido del tumor mamario es fundamental y representa el estándar para el diagnóstico del cáncer de mama. Esta biopsia proporciona información detallada sobre la estructura del tumor, su grado de malignidad y la presencia de receptores hormonales (estrógenos y progesterona) y HER2 (Receptor del factor de crecimiento epidérmico humano 2), que son cruciales para la planificación del tratamiento.
Actualmente, la oncología experimenta una auténtica revolución impulsada por los grandes avances en el campo de la biología molecular y la genómica, lo que ha permitido identificar nuevos biomarcadores específicos del tumor, como son algunas alteraciones de oncogenés o genes supresores implicados en rutas de señalización celular, proliferación, rutas bioquímicas y funciones celulares, que han permitido subdividir y clasificar los tumores de manera más precisa, conocer mejor su evolución y desarrollar tratamientos más específicos.
"La secuenciación del ADN tumoral para identificar mutaciones específicas asociadas al cáncer de mama, como las mutaciones en los genes PIK3CA, HER2, BRCA, ESR1, MSI o NTRK, nos ayudan a establecer la historia natural de la enfermedad (pronóstico), determinar su agresividad; también nos permite individualizar el tratamiento estableciendo qué agentes terapéuticos y su secuencia son los más adecuados (predictivo) para su tratamiento", explica el doctor José Ángel García Sáenz, Oncólogo Médico y Especialista en Cáncer de Mama de la Unidad de Tumores de mama del Servicio de Oncología médica del Hospital Ruber Internacional.
Hasta hace poco tiempo el análisis de las mutaciones de las células tumorales solo se podía realizar con una muestra de tejido obtenida mediante una biopsia o durante una cirugía. Sin embargo, hoy en día se puede realizar esta secuenciación genómica del ADN tumoral a partir del ADN que circula libremente en la sangre de la paciente con cáncer, una técnica conocida como biopsia líquida.
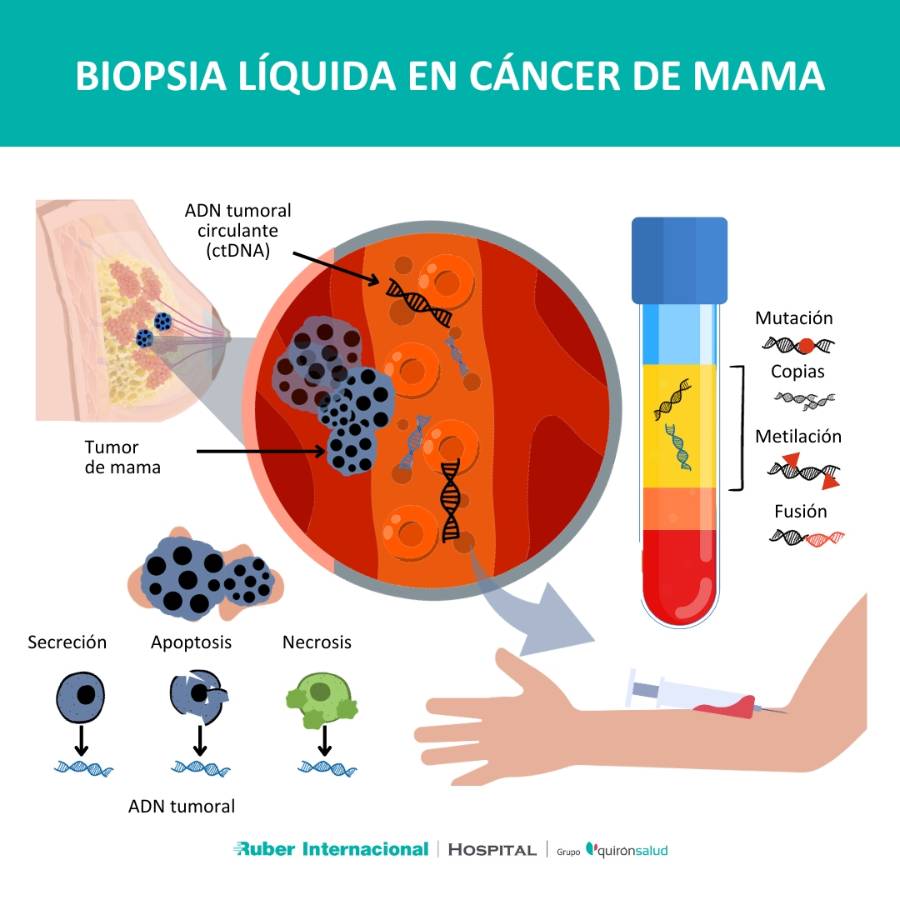
Qué es la biopsia líquida
La biopsia líquida es una técnica no invasiva que permite analizar biomarcadores y mutaciones génicas en el ADN circulante presente en la sangre, la orina u otros fluidos corporales. En el contexto del cáncer de mama, el ADN circulante (ctDNA) se refiere específicamente al ADN tumoral circulante liberado por las células tumorales en el torrente sanguíneo.
El ctDNA tiene su origen en las células tumorales primarias y, en el caso del cáncer metastásico, también en las células tumorales de las metástasis. A medida que las células tumorales proliferan y mueren, liberan fragmentos de su ADN en la sangre, que pueden ser aislados a partir de una muestra de sangre y secuenciados para detectar las mutaciones de interés.
"La idea es identificar dianas potencialmente accionables, que están clasificadas como de categoría I en la Guía de la Sociedad Europea de Oncología Médica (ESMO, por sus siglas en inglés). Estas mutaciones o dianas de categoría I, son las dianas para las que hay un agente terapéutico aprobado que puede modificar la evolución de la enfermedad", señala el especialista.
La Guía ESMO de Dianas Potencialmente Accionables  proporciona información actualizada sobre las dianas terapéuticas conocidas en diferentes tipos de cáncer y las terapias dirigidas disponibles para abordarlas.
proporciona información actualizada sobre las dianas terapéuticas conocidas en diferentes tipos de cáncer y las terapias dirigidas disponibles para abordarlas.
"Por ejemplo, la presencia de mutaciones específicas de la subunidad a en PI3K en tumores metastásicos RE(+)/HER2(-) se asocia con una mayor agresividad biológica y peor pronóstico que cuando no está presente esta mutación. Por otro lado, hay un agente aprobado –alpelisib- que es un inhibidor selectivo de la subunidad a en PI3K, que ha demostrado ser eficaz y seguro en esta situación".
PIK3 (Fosfatidilinositol 3-quinasa alfa) es una enzima que desempeña un papel importante en la regulación de varias vías de señalización celular relacionadas con el crecimiento y la supervivencia celular. Debido a este rol, el PIK3CA se ha convertido en un objetivo importante para la investigación y el desarrollo de terapias dirigidas en el tratamiento del cáncer.
Al ser un procedimiento no invasivo y sin riesgos de complicaciones para el paciente, la biopsia líquida es una excelente herramienta para realizar un seguimiento continuo de la enfermedad a lo largo del tiempo, ya que se pueden realizar análisis de sangre periódicos para evaluar la respuesta al tratamiento y conocer su evolución.
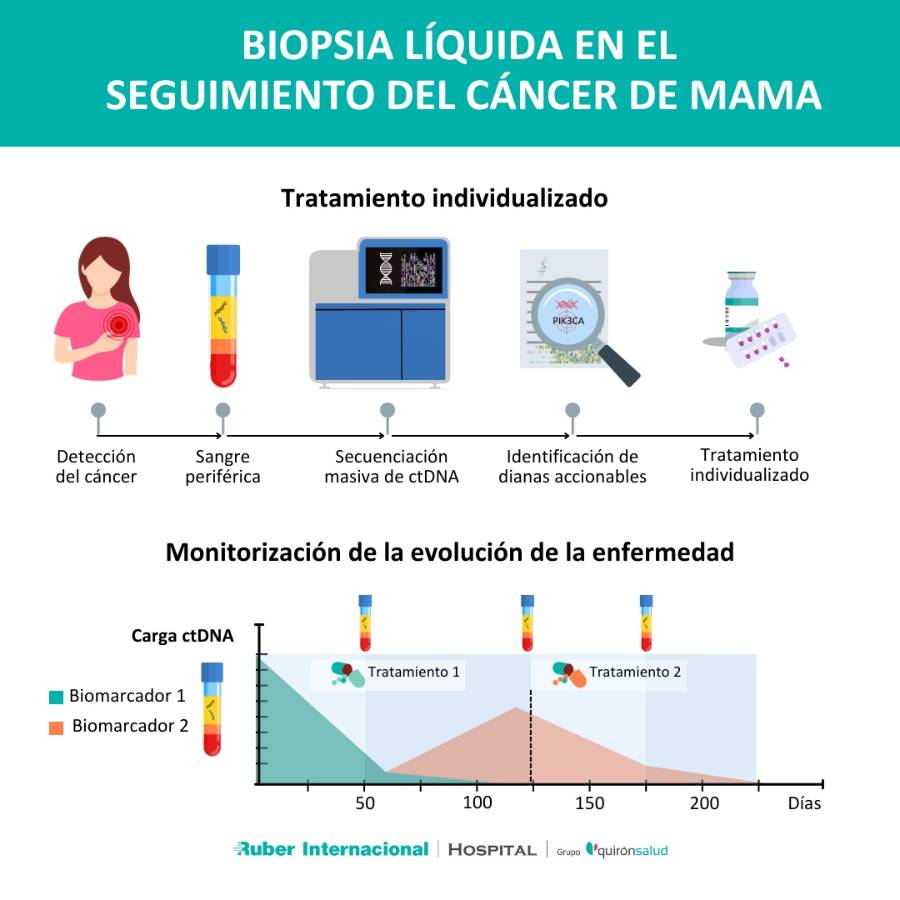
Biopsia líquida en el seguimiento del tratamiento del cáncer de mama
Aunque los niveles de ctDNA pueden variar mucho entre los pacientes, los niveles de ctDNA en un paciente individual a lo largo del tiempo se correlacionan bien con los cambios en la carga tumoral y la respuesta al tratamiento.
"La biopsia líquida puede usarse para monitorizar la enfermedad, de forma complementaria a la evaluación clínica y radiológica. Por ejemplo, si se observa una disminución significativa o un aclaramiento total de la carga de ctDNA esto sugiere una respuesta positiva al tratamiento. Sin embargo, en el caso de que se detecten aumentos en el ctDNA o se identifiquen nuevas mutaciones de resistencia, habría que cambiar la estrategia terapéutica", detalla el especialista en cáncer de mama.
Esta información dinámica sobre los niveles de ctDNA y la identificación de nuevas mutaciones en el tiempo permiten al médico anticipar el nuevo pronóstico del cáncer e identificar aquellas pacientes que no se están beneficiando de un determinado tratamiento antes que sea clínicamente evidente, una clara ventaja sobre la biopsia clásica de tejido tumoral, lo que es especialmente relevante en pacientes metastásicos.
El doctor García Sáenz enfatiza: "Si al monitorizar ctDNA en la primera línea del cáncer de mama metastásico, en los primeros 15 días tras iniciar el tratamiento se produce un aclaramiento de ctDNA respecto a la determinación basal, es muy probable que el control de la enfermedad sea duradero. Pero, si no se produce este aclaramiento precoz, o bien durante la monitorización aparece mayor detección de ctDNA, entonces es probable que estemos ante una progresión clínica inminente. En el caso de que detectemos una diana clínicamente accionable, por ejemplo, PIK3CA, entonces podemos plantear un tratamiento específico frente a la proteína PI3K. Si detectamos mutación en el gen ESR1, en un futuro próximo dispondremos de agentes endocrinos cuya eficacia es relevante en presencia de esta mutación, etc."
Recientemente, el doctor García Sáenz y un grupo de destacados investigadores del cáncer de mama, publicaron sus resultados de un estudio sobre la monitorización por biopsia líquida altamente sensible en pacientes con cáncer de mama metastásico tratados con agentes endocrinos después de la exposición a inhibidores de la aromatasa. Unos resultados que respaldan el uso de la biopsia líquida para el seguimiento del cáncer de mama metastásico.
sobre la monitorización por biopsia líquida altamente sensible en pacientes con cáncer de mama metastásico tratados con agentes endocrinos después de la exposición a inhibidores de la aromatasa. Unos resultados que respaldan el uso de la biopsia líquida para el seguimiento del cáncer de mama metastásico.
Biopsia líquida en el ámbito clínico
Pese a su extraordinario potencial transformador en la lucha contra el cáncer de mama, de momento, la biopsia líquida solo se utiliza de forma asistencial en el cáncer de mama metastásico para conocer su perfil molecular y obtener información pronóstica y predictiva. Sin embargo, existen numerosas líneas de investigación que apuntan a nuevas aplicaciones clínicas.
"En este momento se encuentra en investigación clínica el papel de la biopsia líquida para el diagnóstico temprano del cáncer de mama, su rol en la detección de la enfermedad residual después del tratamiento neoadyuvante o la cirugía, su posible utilidad para monitorizar la respuesta con biopsias seriadas (monitorizar un clon seleccionado) y para la identificación y estudio de nuevas mutaciones o cambios génicos", destaca.
Otra ventaja clave de la biopsia líquida sobre la biopsia clásica de tejido es su capacidad de capturar la heterogeneidad molecular asociada con la resistencia del cáncer. La resistencia adquirida a menudo se caracteriza por el crecimiento clonal de múltiples subclones resistentes en un paciente individual. Estos subclones resistentes pueden coexistir en la misma lesión o en distintos sitios metastásicos. Por lo tanto, una biopsia tumoral de una sola lesión puede no detectar la heterogeneidad molecular, mientras que la presencia de múltiples mecanismos de resistencia a menudo puede ser detectada a partir del cfDNA que se desprende de las células tumorales en todo el cuerpo.
Como toda metodología reciente y en evolución, la biopsia líquida enfrenta desafíos importantes. Para el doctor García Sáenz, uno de ellos es el de poder utilizar la biopsia líquida para identificar la enfermedad molecular residual de los estadios iniciales de cáncer de mama, y, por lo tanto, "buscar terapias adyuvantes extendidas o diferentes para poder prevenir la recurrencia de la enfermedad".
Adicionalmente, cree que en el futuro la biopsia líquida "permitirá identificar la progresión molecular de la enfermedad metastásica antes de que ocurra de forma clínica, y como resultado con tiempo para poder buscar una estrategia terapéutica diferente e individualizada".



